תוֹכֶן
אטומים קטנים מכדי לאפשר מדידה משמעותית של כימיקלים. כדי לעבוד עם כמויות משמעותיות של חומרים אלה, מדענים מקבצים אותם ליחידות הנקראות שומות. שומה מוגדרת כמספר אטומי הפחמן ב- 12 גרם של האיזוטופ פחמן 12, שהם כ 6.022 x 10 אטומים. מספר זה נקרא מספר Avogadro או קבוע. הוא משמש לקביעת מספר האטומים של חומר כלשהו. בנוסף, המסה של שומה אחת של חומר היא המסה הטוחנת.
צעדים
שיטה 1 מתוך 2: חישוב המסה הטוחנת של יסוד
נסו להבין את המסה הטוחנת. זהו המסה (בגרמים) של שומה של חומר. באמצעות המסה האטומית של יסוד ומכפילה אותו בגורם ההמרה גרם למול (g / mol), ניתן לחשב את המסה הטוחנת של אותו יסוד.
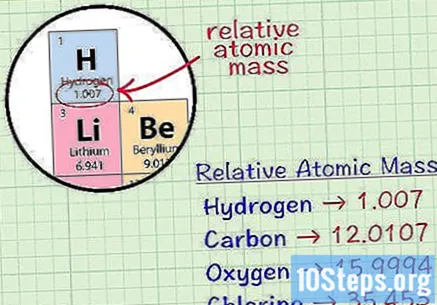
מצא את המסה האטומית היחסית של היסוד. זהו המסה הממוצעת, ביחידות אטומיות, של מדגם של כל איזוטופים של היסוד. מידע זה ניתן למצוא בטבלה המחזורית של האלמנטים. פשוט אתר את האלמנט והמספר יהיה מתחת לסמל שלו. בנוסף, מספר זה לא יהיה מספר שלם, אלא עשרוני.- לדוגמא, עבור מימן, המסה האטומית היחסית היא 1.007; עבור פחמן זה 12.0107; עבור חמצן זה 15.9994; ולכלור זה 35,453.

הכפל את המסה האטומית היחסית בקבוע המסה הטוחנת. זה מוגדר כ- 0.001 ק"ג לשומה, או 1 גרם לשומה. זהו ההמרה של יחידות אטומיות לגרם למול, מה שהופך את המסה הטוחנת של מימן ל- 1.007 גרם למול, לזה של פחמן 12.0107 גרם למול, לחמצן 15.9994 גרם למול ולכלור 35.453 גרם למול.- כמה אלמנטים נמצאים רק עם שני אטומים או יותר במולקולות. המשמעות היא שכדי למצוא את המסה הטוחנת של יסודות המורכבים משני אטומים, כגון מימן, חמצן וכלור, יש צורך למצוא את המסה האטומית היחסית שלהם, להכפיל אותם בקבוע המסה הטוחנת ואז להכפיל את התוצאה לשניים.
- עבור H2: 1.007 x 2 = 2.014 גרם למול; בשביל ה2: 15.9994 x 2 = 31.9988 גרם למול; ובשביל Cl2: 35.453 x 2 = 70.096 גרם למול.
שיטה 2 מתוך 2: חישוב המסה הטוחנת של תרכובת

אתר את הנוסחה הכימית של התרכובת. הוא מורכב ממספר האטומים בכל יסוד המרכיב את התרכובת (מידע זה ניתן לקבל מכל ספר עיון בכימיה). לדוגמא, הנוסחה למימן כלורי (חומצה הידרוכלורית) היא HCl ונוסחת הגלוקוז היא C6ה12ה6. באמצעות נוסחה זו ניתן לזהות את מספר האטומים של כל יסוד המרכיב את התרכובת.- ל- HCl אטום מימן ואטום כלור.
- ה- C6ה12ה6 יש לו שישה אטומי פחמן, 12 אטומי מימן ושישה חמצן.
מצא את המסה האטומית היחסית של כל יסוד התרכובת. בעזרת הטבלה המחזורית, אתר את המסה האטומית היחסית של כל יסוד (המספר שנמצא מתחת לסמל היסוד). באותו אופן כמו חישוב המסה הטוחנת של אלמנט בשלב הראשון, מסות אלה יוכפלו גם ב- 1 גרם למול.
- המסה האטומית היחסית של היסודות המרכיבים חומצה הידרוכלורית היא: 1.007 גרם למול מימן ו- 35.453 גרם למול כלור.
- המסה האטומית היחסית של היסודות המרכיבים גלוקוז הינה: 12.0107 גרם למול פחמן, 1.007 גרם למול מימן ו- 15.9994 גרם למול חמצן.
חשב את המסה הטוחנת של כל יסוד התרכובת. הכפל את המסה האטומית של היסוד במספר האטומים בתרכובת. זה יביא לכמות היחסית שכל אלמנט תורם למתחם.
- המסה הטוחנת של כל יסוד חומצה הידרוכלורית (HCl) היא: 1.007 גרם למול מימן ו- 35.453 גרם למול כלור.
- המסה הטוחנת של כל יסוד גלוקוז (C6ה12ה6) הוא: 12.0107 x 6 = 72.0642 גרם למול פחמן, 1.007 x 12 = 12.084 גרם למול מימן ו 15.9994 x 6 = 95.9964 גרם למול חמצן.
הוסף את המסה הטוחנת של כל יסוד בתרכובת. עשה זאת כדי לקבוע את המסה הטוחנת הכוללת של המתחם. קח את המוצרים שהושגו בשלב הקודם והוסף את כולם עד לקבלת התוצאה.
- המסה הטוחנת של חומצה הידרוכלורית היא: 1.007 + 35.453 = 36.460 גרם למול. המסה של שומה אחת של HCl היא 36.46 גרם.
- המסה הטוחנת של גלוקוז היא: 72.0642 + 12.084 + 95.9964 = 180.1446 גרם למול. המסה של שומה אחת של גלוקוז היא 180.14 גרם.
טיפים
- למרות שרוב המסה האטומית היחסית ידועה בדיוק של חלק אחד בעשרת אלפים (ארבע עשרוניות), ברוב עבודות המעבדה המונים הטוחנות בדרך כלל מצוטטות לשני מקומות עשרוניים, או אפילו פחות, עבור מסות גדולות במיוחד. לפיכך, במעבדה, המסה הטוחנת של חומצה הידרוכלורית תהיה 36.46 גרם למול וזה של גלוקוז 180.14 גרם למול.
חומרים הכרחיים
- ספר כימיה או טבלה מחזורית של אלמנטים
- מַחשְׁבוֹן