תוֹכֶן
- בשלבים
- שיטה 1 צייר את הקשר הקוואלינטי בין שני אטומים
- שיטה 2 קביעת מבנה לואיס של מולקולה פוליאומית
- שיטה 3 מייצגים יון עם נוסחת לואיס
מישהו שמתחיל בכימיה ונתקל לראשונה במבנה של נקודת לואיס (או דיאגרמות של לואיס) מופתע בדרך כלל מהמצג כזה. למעשה, זהו ייצוג של האלקטרונים והקשרים של הערכיות שיכולים, או יכולים, להתקיים בין אטומים בתוך מולקולות מורכבות פחות או יותר. תרשים כזה מייצג רק את השכבות האלקטרוניות החיצוניות. אתה יכול לדמיין שככל שמולקולה מורכבת יותר, התרשים שלה פחות מפורש בקריאה ראשונה. אם ניתן לייצג אטומים או מולקולות יציבות, ניתן לייצג יונים גם כן.
בשלבים
שיטה 1 צייר את הקשר הקוואלינטי בין שני אטומים
-

כתוב את הסמלים הכימיים של האטומים בהצגה. שימו לב אליהם באותו קו וודאו שיש מספיק מקום בין השניים בכדי להיות מסוגלים להתחקות על קריאות אלקטרוניות וקוואלנטיות ויחידות (או לא מותאמות).- קשר קוולנטי הוא קשר כימי בו שני אטומים חולקים שני אלקטרונים, זה קורה דווקא בין שני אלמנטים בקבוצת הלא-מתכות.
-

קבע את דרגת הקשר בין 2 אטומים. לאטומים יכול להיות קשר יחיד, כפול או משולש ביניהם. אופי הקישור ניתן על ידי כלל הדואט והבתים, כלומר אטום, למעט חריגים, מבקש להשלים את שכבת האלקטרונים החיצונית שלו עם 8 אלקטרונים. כדי לחשב את מספר האלקטרונים באטום, עליך למצוא את מספר האלקטרונים של עריכה במולקולה שאתה מכפיל ב -2 (כל קשר מרמז על 2 אלקטרונים) ואז להוסיף את מספר האלקטרונים הלא שכיחים.- לדוגמא, אטום חמצן (O2) יש 6 אלקטרונים ערכיים. הכפל 6 על 2, שנותן לנו 12.
- כדי לאמת ציות לכלל הלוקטט, השתמש בנקודות כדי לייצג אלקטרונים בודדים. מולקולת החמצן עם הנוסחה O2 מורכב משני אטומי חמצן שבכל אחד מהם 6 אטומים בשכבה השנייה, המעניקים 6 כפילות זהב, כלל האוקטט הוא ששכבה זו מכילה 8. כתוצאה מכך, על כל אטום חמצן לבצע שני קשרים קוולנטיים. לכבד את כלל הבתים, רק אחד לא יספיק. הקישורים האלה הוקמו, וכלל הלוקטט מכבד אז עבור שניהם.
-

צייר את הקישורים על הייצוג שלך. כל קישור מיוצג על ידי קו בין שני האטומים. קשר פשוט מיוצג על ידי קו פשוט המאחד, בלי לגעת, בסמלים של שני האטומים. קישור כפול או משולש יוצג על ידי שניים או שלושה שורות, בהתאמה.- לפיכך, שני אטומי החנקן (N2) מאוחדים על ידי קשר משולש. באיור למעלה ניתן לראות בבירור את שלושת הקווים המחברים בין שני אטומי החנקן (N).
-

ציין את האלקטרונים הבלתי מוגבלים. חלק מאלקטרוני הערך של אטום אחד או שניהם עשויים שלא להיות קשורים. במקרה זה, רצוי לייצג כל אחד בנקודה סביב האטום שלו. יהיה זה ככל שיהיה, בשכבת האטומים החיצונית אסור שיהיו יותר מ- 8 אלקטרונים. כדי לאמת את הייצוג שלך, עליך לספור כל נקודה כאלקטרון וכל קו כשני אלקטרונים.- לדוגמה, שני אטומי החמצן (O2) יש ביניהם קישור כפול (שני שורות), אליו מתווספים 2 זוגות נקודות שתפיץ גאומטרית סביב הסמל.
שיטה 2 קביעת מבנה לואיס של מולקולה פוליאומית
-
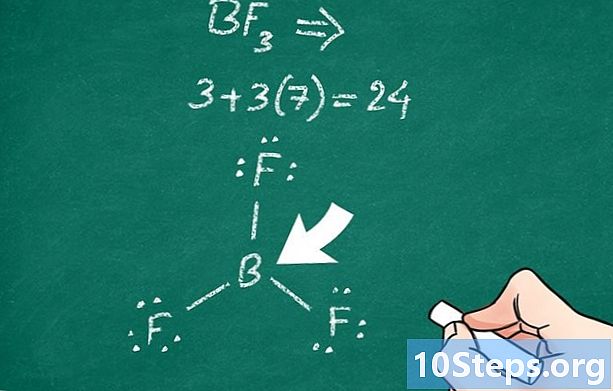
קבע איזה אטום הוא האטום המרכזי. לרוב מדובר באטום אלקטרונגטיבי, כלומר שיש לו אלקטרונים אחד או יותר המסוגלים להיקשר לאטומים אחרים. ניתן לראות את השם "מרכזי" על הייצוג: זהו האטום המחובר ביותר לאחרים, מבלי שהם בהכרח קשורים זה לזה.- חלק מהאטומים, כמו זרחן או פחמן, נוטים לרוב להיות האטום המרכזי.
- בכמה מולקולות מורכבות, ייתכן שיש כמה אטומים מרכזיים.
- שים לב כי בטבלת האלמנטים התקופתיים, האלקטרוניטיביות עולה משמאל לימין, אך יורדת מראש הטבלה כלפי מטה.
-
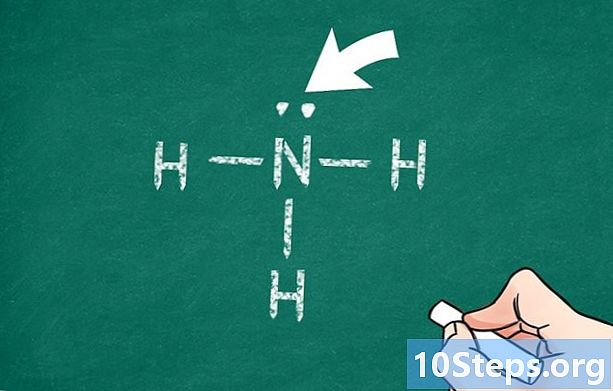
שימו לב לאלקטרונים של הערך החבוי המרכזי. ככלל, גם אם ישנם חריגים, האטומים מנסים להשלים את שכבת הערכיות שלהם, כאן עם 8 אלקטרונים (זהו כלל הלוקטט). כאשר הלום המרכזי נקשר לאטומים אחרים, האלקטרונים ממוקמים לרוב על רמות האנרגיה הנמוכות ביותר האפשריות (עיקרון פאולי), כך שכלל הבייט מתקיים. זה יעזור לך למצוא את מספר הקשרים בין אטום מרכזי זה לבין האטומים האחרים של המולקולה, כאשר כל קשר מייצג 2 אלקטרונים.- כמה אטומים גדולים, זהו המקרה של זרחן, אינם מספקים את כלל הלוקטט.
- אז, במולקולה של פחמן דו חמצני (CO2) יש שני אטומי חמצן אשר לכל אחד מהם קשר כפול קוולנטי עם הלום המרכזי, הפחמן. לאחר מכן מכבדים את שלטון הלוקטט לשלושת האטומים.
- זרחן פנטאכלוריד (PCl5), מולקולה יציבה, אינה מספקת באופן מלא את כלל האוקטט. אכן, המולקולה מורכבת מחמישה אטומי כלור, כל אחד בקשר קוולנטי פשוט עם לוטום מרכזי, זה של זרחן. כלל הבתים מסתפק בכל אחד מחמשת אטומי הכלור, זה לא עבור אטום הזרחן.
-

כתוב את סמל האטום המרכזי שלך. כדי לייצג מולקולה קוולנטית מורכבת, עדיף להתחיל בסימן האטום המרכזי. לעתים קרובות הפיתוי גדול להציב את כל הסמלים בהתחלה, אך במקרים אלה, יש צורך להתחיל עם האטום הראשי. וודאו כי הסמל המרכזי מוקף מספיק מקום בכדי לציין את שאר האטומים והקישורים שיגיעו בזמנם. -

הכן את סידור האטומים סביב לוטום מרכזי. עבור כל זוג אלקטרונים בודדים, ציין שתי נקודות קרובות באחד מארבעת הכיוונים (צפון, דרום, מזרח, מערב) של הלום המרכזי. כל קשר בודד מיוצג על ידי קו החל מאותו אטום. אם הקישור כפול או אפילו משולש, זה יהיה בהתאמה קו כפול או משולש. אז הכל מוכן להשלמת התרשים. -
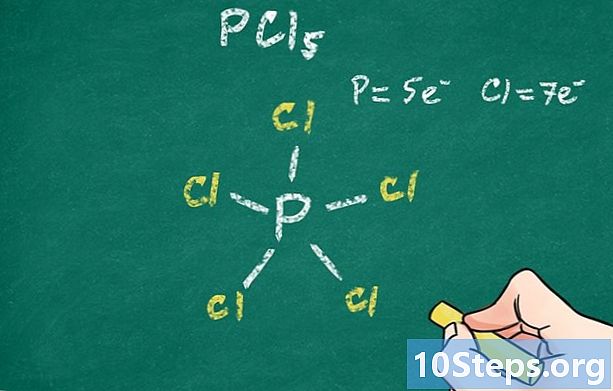
הוסף את שאר האטומים. כל אחד מהאטומים האחרים של המולקולה נקשר אפוא לאטום המרכזי על ידי קשר (יחיד, כפול או משולש). הסמלים של אלמנטים אלה ימוקמו אפוא בקצה השני של הקווים החל מלטום מרכזי. לאחר מכן כל כימאי יבין את טיב הקשרים בין אטומים אלה ללטום המרכזי. -

ציין את שאר האלקטרונים. כל קשר בודד סופר 2 אלקטרונים, הכפול ל -4 ולבסוף הקשר המשולש עבור 6 אלקטרונים. בצע ספירה של האלקטרונים שכבר הועסקו, ואז הוסף סביב כל אחד מהאטומים את זוגות האלקטרונים כך שכלל הלוקטט יתאים לכל אחד מהאטומים. אישור יינתן אם אתה סופר אלקטרון אחד לכל נקודה ושניים לכל שורה. סכום האלקטרונים של השכבה האחרונה חייב להיות 8.- כלל הלוקטט הזה יודע עם כמה אטומים חריגים שיהיה ארוך מכדי להזכיר כאן, רק להזכיר מימן או הליום, האלמנטים הראשונים בטבלה המחזורית שיש להם מבנה אטומי מאוד מסוים.
- אם למולקולה אחת של מימן הייתה קשר קוולנטי לאטום אחר, בהגדרה, היא לא הייתה יכולה להיות אחרת עם אטום אחר: אין לה עוד אלקטרון בודד.
שיטה 3 מייצגים יון עם נוסחת לואיס
-

הזן את הסמל הכימי של האטום. ליון יש לסמל אותו סמל של היסוד ממנו הוא נגזר סמל כימי (למשל האטום Cl והיון Cl). וודא שיש מספיק מקום סביב הסמל למקם אלקטרונים ווים. חלק מהיונים הם למעשה מולקולות פוליומטיות (המורכבות מכמה אטומים): במקרה זה, הסמלים המשמשים יהיו אלה של כל יסודות המולקולה.- כדי להשיג את סמל היון הפוליטומי (כגון NO3 או SO4), סקור את הנאמר לעיל בשיטה השנייה (לבסס את מבנה לואיס של מולקולה פוליאומית) של מאמר זה.
-

דמות האלקטרונים. אטומים הם בהגדרתם ניטרלים חשמלית: הם אינם שליליים ואינם חיוביים. אם במהלך תגובה כימית כלשהי, אטום כזה היה מאבד או משיג אלקטרון אחד או יותר, האטום היה טעון חיובי או שלילי: הוא יהפוך ל יון. בתרשים שלך, תצטרך, בהתאם למקרה, להוסיף או להסיר את האלקטרונים הנודדים האלה.- כשאתה מחבר אלקטרונים, שמור תמיד על כלל הבתים בפינה אחת בזיכרון שלך.
- אטום שמאבד אלקטרונים הופך ליון חיובי (קטיון). כך שאם ליתיום מאבד בתגובה את האלקטרון היחיד בשכבה האחרונה שלו, הנוסחה של לואיס תהיה צודקת li בלי נקודה מסביב.
- כאשר אלקטרונים נאספים על ידי אטום, הוא הופך ליון שלילי (אניון). כלור, על שבעת האלקטרונים של הערך שלו, מרוויח במהלך יינון אלקטרון להשלים את השכבה האחרונה שלו (8 אלקטרונים). דיאגרמת לואיס של יון הכלוריד (Cl) מראה אפוא אטום עם ארבעה זוגות אלקטרונים בכל אחד מהכיוונים.
-
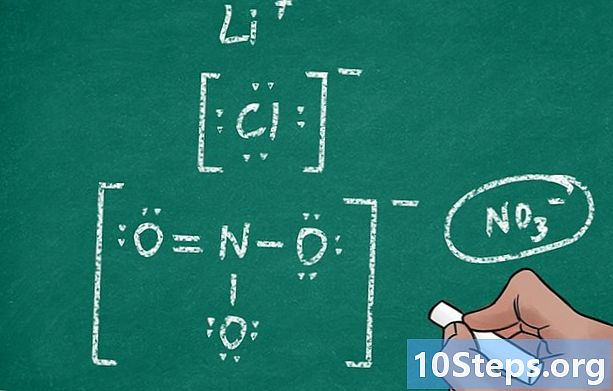
ציין את עומס האריה. מייונים עבור היונים המורכבים והלא שכיחים לקבוע את מטען היון על ידי ספירת נקודות האלקטרונים. כמו כן, הוחלט לצרף באופן חיובי יותר את החיוב. לאחר מכן ממוסגר היון על ידי שני ווים, ובפינה השמאלית העליונה של הימין, יוזכר המטען החשמלי.- אם כן, ביוני המגנזיום חסרים שני אלקטרונים בשכבה החיצונית שלו, כתיבתו תהיה כדלקמן: או.